با توجه جابجایی مجموعه فروش بسته شده است
از سفارش خوداری کنید
شروع کار اعلام خواهد شد
در صورت لزوم 09383323434 می توانید تماس بگیرید

ممکن است در ذهن هر شخصی این موضوع به وجود بیاید که انسانها فقط در طی قرون اخیر به فناوری توجه کردهاند و تا پیش از آن موضوع فناوری از جذابیت زیادی برخوردار نبوده است؛ ولی باید به شما عزیزان بگوییم بررسیهای باستان شناسان نشان میدهد که ریشه بسیاری از فناوریهای امروزی، در زمان بسیار دور است.
بله دوستان عزیز، در این مقاله با ما همراه باشید تا اولین باتری را به شما معرفی کنیم و سیر تکامل آن از گذشته تا حال را برایتان شرح دهیم. مطمئن باشید از خواندن این مطالب جذاب، حسابی شگفتزده خواهید شد.
تاریخچه اولین باتری و سیر تکامل آن تا امروز
ممکن است در ذهن هر شخصی این موضوع به وجود بیاید که انسانها فقط در طی قرون اخیر به فناوری توجه کردهاند و تا پیش از آن موضوع فناوری از جذابیت زیادی برخوردار نبوده است؛ ولی باید به شما عزیزان بگوییم بررسیهای باستان شناسان نشان میدهد که ریشه بسیاری از فناوریهای امروزی، در زمان بسیار دور است.
بله دوستان عزیز، در این مقاله با ما همراه باشید تا اولین باتری را به شما معرفی کنیم و سیر تکامل آن از گذشته تا حال را برایتان شرح دهیم. مطمئن باشید از خواندن این مطالب جذاب، حسابی شگفتزده خواهید شد.
یکی از مصنوعات تولید شده به وسیله بشر باتری یا پیل الکتریکی است که تاریخ ساخت آن به پیش از میلاد مسیح مربوط است. اولین باتری ساخته شده در جهان، باتری یا پیل اشکانی (Parthian Battery) نام دارد که در حدود سال 200 قبل از میلاد مسیح در دوران پادشاهی اشکانیان ساخته شده است.
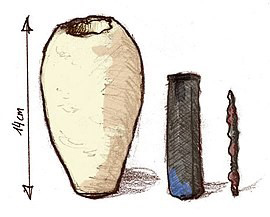
در سال 1936 آقای ویلهم کونیگ (Wilhem Konig) توانست باتری اشکانی (Parthian Battery) در روستای «خوجوت رابه» کشف کرد. این روستا در عراق کنونی واقع است و توسط پادشاهی اشکانی به وجود آمده و بالغ بر 2000 سال قدمت تاریخی دارد و به همین دلیل است که باتری اشکانی به باتری یا پیل بغداد نیز معروف است.
جالب است بدانید که بیش از یک عدد از این پیلها در زمان اکتشافات انجام گرفته پیدا شده است. علاوه بر این آقای «John Simpson» (جان سیمپسون) به این اعتقاد دارد که این باتری یا پیل به علتهای گوناگونی همچون فرک شکل کوزه متعلق به دوران ساسانیان است در حالی که «Wihlem Konig» (ویلهم کونیگ) یه این اعتقاد دارد که این پیل متعلق به دوره اشکانیان است.

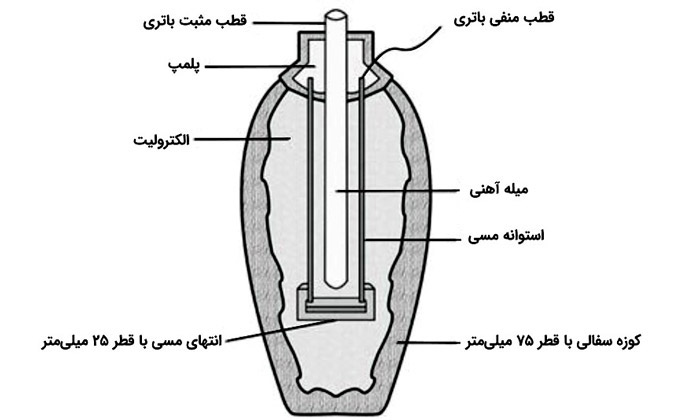
پیل اشکانی همان طور که در تصویر مشخص است از سه بخش تشکیل شده است که شامل یک میله آهنی به طول 7.5 سانتی متر، یک استوانهی مسی با قطر 2.6 سانتی متر و طول 9.8 سانتی متر و یک کوزه سفالی تخم مرغی شکل به ارتفاع 14 سانتی متر، قطر 8 سانتی متر و دهانه 3.3 سانتی متری است.
علاوه بر این میله آهنی به صورت معلق درون استوانه مسی قرار گرفته که هیچ گونه تماسی با آن نداشته باشد. مجموعه میله آهنی و استوانه مسی به وسیلهی یک «Asphalt Plug» (درپوش آسفالتی) پلمپ شده و در جای خود ثابت شدهاند. البته این نکته را میبایست بگویم که این استوانه مسی ضد آب نبوده و اگر کوزه از مایعی پر بشود آن گاه میله آهنی نیز پر از آن مایع خواهد شد.
البته این موضوع که در این پیل از چه الکترولیتی استفاده شده است مشخص نیست ولی بر طبق آزمایشهای انجام شده به وسیلهی محققان، این احتمال وجود دارد که الکترولیت موجود در این پیل شامل محلول آب لیمو، سرکه و یا مس است و شناخت مردمان آن دوره با جوهر سرکه (استیک اسید) و جوهر لیمو (سیتریک اسید) دلیل این گمانه زنیها است.
بر طبق محاسبات تئوری صورت گرفته، به نظر میرسد که میزان ولتاژ تولید پیل اشکانی 79 ولت است. ولی در آزمایشهای عملی میزان ولتاژ تولیدی این پیل شاهد اعداد و ارقام گوناگونی هستیم. محققان بارها بر روی این عقیده و باور که بیان میدارد که پیل اشکانی در شرایط خاص جهت تولید برق بکار میرفته را مورد بررسی و آزمایش قرار دادهاند.
محققان در یک برنامه تلویزیونی در طی یک آزمایش کوزهای را با سرکه پر کرده و از آن برای تولید نیم ولت الکتریسیته استفاده کردند و بیان داشتند که ما میتوانیم با استفاده از این ولتاژ، یک مجسمه از جنس نقره را با استفاده از سیانیداسیون طلا در طی مدت دو ساعت آبکاری کرد.
محققان در آزمایشی دیگر برای فعال کردن واکنشهای الکتروشیمیایی بین مس (Cu) و آهن (Fe) از کوزه سفالی و آب لیمو به عنوان الکترولیت استفاده کردند. در ادامه به صورت سری و پشت سرهم، چهار پیل ساخته شده را به یکدیگر متصل کردند و در نتیجه توانستند 4 ولت الکتریسیته تولید کنند.
ما میتوانیم با سری (پشت سر هم) وصل کردن پیلها به یکدیگر، ولتاژ مورد نیاز جهت آبکاری یک نقطه کوچک از یک فلز (Badge) و یا آبکاری سوزنهای مورد استفاده در پزشکی و طب سوزنی استفاده میشوند را فراهم کرد. ولی این ولتاژ برای انجام امر شک دادن به افراد مناسب نیست و بسیار کم است.
کاربرد باتری اشکانی در زمان قدیم
هنوز برای محققان نیز به طور قطع مشخص نیست که در دوران قدیم از این باتری یا پیل چه استفادهای میشده است. مطابق با نظریه ارائه شده توسط چندین محقق در دوران قدیم از این باتری اشکانی که نوعی باتری گالوانی به حساب میآید جهت آبکاری الکترولیتی و یا نوعی از الکتروتراپی استفاده میشده است. ولی با این حال به نظر میرسد که هیچشی آبکاری شدهای متعلق به این دوره تاریخی پیدا و کشف نشده است.

در زمانهای قدیم، استفاده از سوخت یا بخار تنها روش تولید انرژی قابل حمل بود. به جرأت میتوان گفت که زندگی با اختراع باتری راحتتر از قبل شده است. همهی افراد در دنیای امروز برای آسان شدن کارهای روزانه خود به دنبال دستگاههای قابل حمل هستند در نتیجه برای رفع نیاز تولید انرژی در دستگاههای قابل حمل میتوان از باتری استفاده کرد.

اصطلاح باتری
در گذشته از کلمه باتری برای توصیف مجموعهای اجسام مشابه استفاده میشده است که در جهت انجام یک کار با یکدیگر دسته بندی میشدهاند.
بنجامین فرانکلین برای نخستین بار در سال 1749 از اصطلاح باتری برای توصیف مجموعهای از خازنها که در آزمایش الکتریکی خودش در کنار یکدیگر قرار گرفته بودند، استفاده کرد.
آلساندرو ولتا (Alessandro Volta) در سال 1800 میلادی فهمید که اگر از یک مایع خاص به عنوان رسانا استفاده کند قادر خواهد بود به طور مداوم برق تولید کرد. این کشف باعث ساخت اولین پیل ولتایی یا همان باتری شد.
پیل ولتایی از واکنش شیمیایی برای تولید انرژی الکتریکی استفاده میکند. در این پیل، آند و کاتد در مخالف یکدیگر ساخته میشوند. در کاتد، عمل کاهش و در آند، عمل اکسایش اتفاق می افتد و از پل نمکی در بین کاتد و آند برای تکمیل مدار استفاده میشود. علاوه بر این از یک مدار خارجی جهت هدایت جریان الکترونها استفاده میشود. به قسمتهایی که در آن کاهش و اکسایش رخ میدهد، نیم سلول گفته میشود.
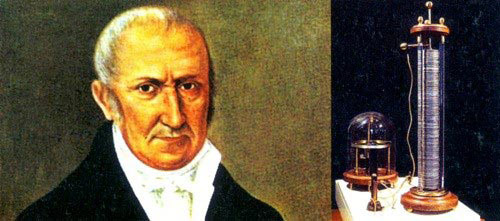
پیل ولتا دو مشکل اساسی داشت:
اول این که توده موجب خارج شدن الکترولیت از پارچه میشد و در نتیجه خواص شیمیایی خاص اجزا در مدت زمان بسیار کوتاهی (در حدود یک ساعت) عمل میکرد. دویست سال بعدی جهت کامل کردن پیل ولتا و از بین بردن مشکلات این پیل صرف شد.
آقای William Cruikshank (ویلیام کریکشنک) اهل بریتانیا (اسکاتلند) و شیمی دان، مشکل نشت را با تعبیه کردن خنک کننده باتری در کنار پیل ولتا حل کرد.
دومین مشکل پیل ولتا، طول عمر کوتاه آن بود که بر اثر از بین رفتن «روی» به دلیل وجود ناخالصی و به وجود آمدن حبابهای هیدروژنی بر روی «مس» رخ میداد.
در سال 1835 آقای William Sturgeon (ویلیام استوروژن)، فیزیک دان بریتانیایی کشف کرد که میتوان با اضافه کردن «زینک» به «جیوه» از تخریب جلوگیری کرد.
پیل دانیل
در سال 1836 میلادی John Frederic Daniell (جان فردریک دنیل)، شیمی دان بریتانیایی برای جلوگیری از انباشته شدن روی کاتد مس از یک الکترولیت دیگر که با هیدروژن واکنش شیمیایی انجام میداد، استفاده کرد. باتری دو الکترولیتی دنیل که به عنوان سلول یا پیل دنیل نیز شناخته میشود.
در پیل دنیل، یک ظرف توسط یک شکاف به دو قسمت مجزا تقسیم میشود که خود این شکاف از یک غشای نفوذپذیر نسبت به یونها تشکیل شده است. در یکی از قسمتهای مجزای ظرف الکترود روی در محلول روی سولفات قرار میگیرد و در قسمت دیگر ظرف الکترود مس در محلول مس سولفات قرار میگیرد. این پیل تا وقتی که سولفات روی یا سولفات مس مصرف میکند میتواند به تولید جریان ادامه دهد. این آزمایشات را آقای John Dancer (جان دنسر) ادامه داد و در نهایت توانست نخستین باتری با طراحی پر منفذ یا متخلل را به وجود آورد.

گاستون پلانته
آقای گاستون پلانته (Gaston Plante)، پزشک و فیزیک دان فرانسوی باتری سرب اسید را در سال 1859 اختراع کرد. گاستون پلانته، دو ورق نورد سرب را درون محلول اسید سولفوریک قرار داد و این باتری را اختراع کرد که طراحی ساده این باتری، با معکوس کردن شارش جریان باعث شارژ مجدد این باتری میشود. این باتری به عنوان نخستین باتری با قابلیت شارژ شناخته میشود.
کامیل آلفونس فوره (Camille Alphonse Faure) در سال 1881، با تبدیل ورقههای سرب به صفحات سرب باعث بهبود عملکرد طراحی پلانته شد.
باتری خشک
الکترولیت موجود در باتریها تا اواخر دهه 1800 در حالت مایع بود. به همین دلیل امر حمل بار الکتریکی را بسیار دشوار بود و در نتیجه بیشتر باتریها برای حرکت و اتصال به مدار ساخته نمیشدند.
ژرژ لکنان (Georges Leclanche) فرانسوی در سال 1866 یک باتری ساخت که اجزای آن شامل یک کاتد از جنس منگنز دی اکسید، یک آند از جنس روی و الکترولیت از جنس محلول آمونیوم کلرید میشدند. با این حال الکترولیت استفاده شده در سلول لکانچه در حالت مایع قرار داشت ولی باز یک قدم مهم برای اختراع باتری خشک به حساب میآمد.
پزشک آلمانی، کارل گسنر (Carl Gessner) در سال 1888، با مخلوط کردن گچ و مواد شیمیایی آب دوست با الکترولیت آمونیوم کلرید، باتری خشک قابل حمل را اختراع کرد. این باتریهای خشک جدید به میزان بسیار زیادی تولید شدند و به محبوبیت بسیار زیادی تا اواخر دهه 1950 دست یافتند.
البته این باتریهای خشک جدید، باتری روی کربن نیز نامیده میشوند که در این سلولها کربن به عنوان یک هادی الکتریکی نقش بسیار مهمی بر عهده دارد با اینکه در واکنش شیمیایی استفاده نمیشود.

Waldemar Jungner
والدمر جانگنر (waldemar jungner) سوئدی در سال 1899 میلادی، با استفاده از کادمیوم (Cd) به عنوان الکترود منفی (آند) و نیکل (Ni) به عنوان الکترود مثبت (کاتد) توانست باتری نیکل کادمیم (NiCd) را اختراع کند.
در سال 1901، فلز آهن توسط توماس ادیسون جایگزین کادمیوم در باتری نیکل کادمیوم شد و این باتری نیکل آهن (NiFe) نامیده شد. از معایب باتری نیکل آهن میتوان به خودسوزی بالا، عملکرد ضعیف در دمای پایین و انرژی ویژه کم اشاره کرد.
اسچلچت و اکرمن با اختراع صفحه قطب متخلخل در سال 1932 باعث افزایش طول عمر باتری نیکل کادمیوم شدند و به جریان بار بالاتر نیز دست یافتند.
Georg Neumann (جرج نیمان) آلمانی در سال 1947 میلادی موفق به مهر و موم کردن باتری شد.
Lewis Urry و Paul Marshall و Karl Kordesch از شرکت Union Carbide در دهه 1950 میلادی یک ماده قلیایی یا به اصطلاح آلکالین (Alkaline) را جایگزین الکترولیت کلرید آمونیم کردند.
در دهه 1960 میلادی، باتریهای آلکالین بسیار محبوب و پرطرفدار بودند. در آن زمان باتری آلکالین جایگزین باتریهای روی کربن شده بودند. باتریهای خورشیدی قلیایی قادر به نگهداری انرژی بیشتری نسبت به باتریهای روی کربن هستند و عمر مفیدتری دارند.
شرکت مخابراتی Comsat در دهه 70 میلادی، جهت استفاده در ماهوارههای ارتباطی اقدام به توسعه باتری نیکل هیدروژن کرد. باتریهای نیکل هیدروژن میتوانند گاز هیدروژن را در قالبهای گاز تحت فشار ذخیره کنند. از باتری نیکل هیدروژن برای بسیاری از ماهوارهها و ایستگاههای فضایی استفاده میکنند.
باتری نیکل هیدرید متال (NiMH) توسط محققان چندین شرکت تولید شد و در سال 1989 به بازار عرضه شدند و در مقایسه با باتریهای نیکل هیدروژن از حجم کوچکتر و قیمتی ارزانتر برخوردار بود.
تولید باتریهای لیتیوم یون در سال 1991 توسط شرکت ژاپنی سونی «جنبه تجاری» یافت ولی شرکت ژاپنی تولید کننده مواد شیمیایی آساهی (Asahi) برای نخستین بار در سال 1985 موفق شده بود باتری لیتیوم یون را بسازد.
در اواخر دهه 1990 بود که برای باتریهای لیتیوم یون یک محفظه نرم و انعطاف پذیر ساخته شد و باعث به وجود آمدن باتریهای لیتیوم پلیمر شد.
شیمی عمومی باتریها
یک باتری از سه لایهی جداکننده، آند و کاتد تشکیل شده است. به لایه مثبت باتری کاتد و به لایه منفی آن آند گفته میشود. اگر به یک باتری بار الکتریکی اضافه شود آن گاه شاهد شارش جریان از آند به کاتد خواهیم بود. اگر باتری را به شارژر آن متصل کنیم آنگاه شاهد شارش جریان از کاتد به آند خواهیم بود.
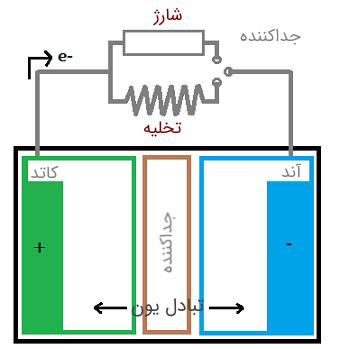
اساس کار هر باتری واکنش شیمیایی اکسایش کاهش است. واکنش اکسایش کاهش از طریق الکترولیت (جدا کننده) و بین آند و کاتد اتفاق می افتد. در پی این واکنش الکترود کاتد بار الکترون میگیرد و کاهش مییابد و الکترود آند نیز الکترون از دست میدهد و اکسایش مییابد. این واکنش زمانی اتفاق می افتد که دو نوع فلز متفاوت درون محلول الکترولیت یکسانی قرار بگیرند.
به طور کلی یکی از فلزها الکترون از دست داده و دیگر فلز الکترون میگیرد که این اختلاف الکترون این دو فلز باعث به وجود آمدن «اختلاف پتانسیل الکتریکی» خواهد شد. منبع ولتاژ در هر وسیلهی الکتریکی همین اختلاف پتانسیل الکتریکی موجود است. به این گونه که یونها از راه جداکننده جریان مییابند و تمام حرکات از آند به کاتد توسط جداکننده مسدود میشود؛ پس در نتیجه پایانههای باتری تنها راه دریافت جریان خارجی به حساب میآید.
معمولاً برای کاربردهای صنعتی و در لوازم خانگی از باتریها استفاده میشود. به طور کلی دو نوع باتری وجود دارد: 1- پیلهای اولیه 2- پیلهای ثانویه. با این حال میتوانیم باتریها را در چهار دسته اصلی تقسیم بندی کنیم: 1- پیل اولیه 2- پیل ثانویه 3- پیل یدک 4- پیل سوختی
هنگامی که انرژی ذخیره شده باتریهای اولیه (پیل اولیه) به طور کامل مورد استفاده قرار میگیرد، غیر قابل استفاده میشوند چرا که در این باتریها ذخیره مجدد انرژی به وسیلهی منبع خارجی امکان پذیر نیست و به همین علت پیلهای اولیه، باتریهای یک بار مصرف نامیده میشوند.

قطبیده شدن باتریهای اولیه عامل اصلی کاهش طول عمر این باتریها به حساب میآید. از واقطبیدگی شیمیایی استفاده میشود تا عمر باتریها با کاهش اثر قطبیدگی افزایش یابد. واقطبیدگی شیمیایی یعنی با اضافه کردن عامل اکسیدکننده به پیل موجب اکسید شدن هیدروژن با آب شد. بطور مثال از منگنز دی اکسید در پیل لکانشه و روی کربن استفاده میشود.
چندین کاربرد پیلهای اولیه
• ساعت و اسباب بازی
• وسایل خانگی کوچک
• چراغهای قابل حمل ضروری (چراغ قوه)
• و...
انواع باتریهای اولیه (غیر قابل شارژ)
• باتری روی کربن
• باتری قلیایی
• پیلهای نقره اکسید
• پیلهای لیتیومی
• پیلهای روی هوا
پیلهای ثانویه را میتوان با متصل کردن به شارژ به مدت بسیار زیادی قبل از تعویض الزامی، مورد استفاده قرار داد. معمولاً برای تهیه باتریهای ثانویه که قابل شارژ هستند، میبایست هزینه بیشتری به نسبت باتریهای اولیه (یک بار مصرف) صرف کرد. ولی با این حال مجموع اثر محیط زیستی و هزینه مالکیت باتریهای ثانویه کمتر است؛ چرا که قبل از نیاز به تعویض میتوان چندین دفعه باتریهای ثانویه با قیمت ارزان دوباره شارژ کرد.
چندین کاربرد پیلهای ثانویه (باتریهای ثانویه)
• ساعتهای هوشمند و دست بندهای سلامتی
• کاربردهای نظامی
• دوربینها
• و...
انواع باتریهای ثانویه (قابل شارژ)
• باتری سرب اسید
• باتری لیتیوم یون (Li-ion)
• باتری نیکل هیدرید فلز (Ni-MH)
• باتری نیکل کادمیوم (Ni-Cd)
تفاوت پیلهای اولیه و ثانویه
از نظر طراحی، پیلهای ثانویه (قابل شارژ) از نمک مذاب یا مایع ساخته میشوند ولی پیلهای اولیه (غیر قابل شارژ) به طور معمول خشک هستند یعنی از مایع پر نشدهاند و به جای آن مملو از خمیری هستند که توانایی جابه جایی را به یونهای داخل باتری میدهد و به همین علت است که پیلهای یک بار مصرق در برابر نشت کردن مقاوم هستند.
علاوه بر این پیلهای اولیه به علت سبک بودن و طراحی سایز کوچک برای وسایل قابل حمل مناسب هستند ولی برخلاف این باتریها، پیلهای ثانویه مناسب وسایل قابل حمل نیستند.
از دیدگاه مشخصات، پیلهای ثانویه دارای واکنش شیمیایی برگشت پذیر، مقاومت داخلی پایین و طراحی پیچیده هستند؛ در حالی که پیلهای اولیه از ظرفیت بالاتر، مقاومت داخلی بالا و طراحی کوچکتری برخوردار هستند.
علاوه بر این پیلهای اولیه توانایی خوبی در نگهداری شارژ دارند، در حالی که پیلهای ثانویه از نگهداری شارژ پایینی برخوردار هستند. پیلهای اولیه برای کاربردهای پرهزینه نامناسب هستند درحالی که برای پشتیبانی و کاربردهای پرهزینه توصیه میشود از پیلهای ثانویه استفاده شود.
هزینه اولیه پیلهای اولیه کم است در حالی که هزینه اولیه پیلهای ثانویه زیاد است. پیلهای اولیه محدود به کاربردهای خاص هستند؛ در حالی که پیلهای ثانویه، کاربردهای بسیار زیادی دارند؛ چرا که از تنوع بسیار زیادی برخوردار هستند.
پیل یدک
الکترولیت باتریهای یدک (Reserve Battery) در حالت جامد و غیر فعال است و تا زمانی که دمای آن به نقطه ذوب نرسد، غیرفعال باقی میماند و در لحظه رسیده به دمای نقطه ذوب بلافاصله هدایت یونها آغاز شده و باتری فعال میشود. علاوه بر این از عنوان باتری اضطراری (Stand by Battery) برای باتریهای یدک نیز استفاده میشود.
انواع باتریهای یدک (Reserve Battery)
• باتریهای فعال شده با گاز
• باتریهای فعال شده با آب
• باتریهای فعال شده الکترولیتی
• باتریهای فعال شده با حرارت
چندین کاربرد از باتریهای یدک
• باتریهای اتومبیل و سایر وسایل نقلیه
• سیستمهای تسلیحاتی
• دستگاههای سنجش فشار و زمان
• و...
پیل سوختی
مواد فعال در پیلهای سوختی از منبع خارجی تغذیه میشوند. پیلهای سوختی تا زمانی قادر به تولید انرژی الکتریکی هستند که مواد فعال به وسیلهی الکترودها مورد تغذیه قرار بگیرند. غشای تبادل پروتون در این پیلها از گازهای اکسیژن و هیدروژن به عنوان سوخت بهره میبرد. واکنش شیمیایی در درون پیل رخ میدهد که در نتیجه این واکنش حرارت، الکتریسیته و آب تولید میشود. کاتد، آندف الکترولیت و کاتالیزگر اجزای اصلی پیلهای سوختی به حساب میآیند.
مزایای پیلهای سوختی
• پیلهای سوختی به علت نداشتن اجزای متحرک، مناسب حمل و نقل بوده و بسیار مطمئن است.
• جلوگیری فرایند تبدیل مستقیم انرژی پتانسیل شیمیایی به انرژی الکتریکی از گلوگاه حرارتی در پیلهای سوختی
• پیلهای سوختی در مقایسه با سایر پیلها به محیط زیست آسیب نسبتاً کمتری میرساند؛ به این دلیل که در این پیلها، هیدروژن تولید میشود که با محیط زیست سازگار است.
چندین کاربرد از پیلهای سوختی
• غالباً در زمان قطع برق از پیلهای سوختی به عنوان پشتیبان جهت تولید الکتریسیته استفاده میشود.
• در وسایل حمل و نقل همچون اتومبیلها، موتور سیکلت و سایر وسایل نقلیه غالباً از پیلهای سوختی استفاده میشود.
و در آخر ...
امیدواریم از مطالبی که در این مقاله در اختیار شما قرار دادیم، بهره کافی برده باشید. از شما دوستان عزیز و همراهان همیشگی تقاضا داریم که با نظرات و پیشنهادات سازنده خود ما را در بهبود کیفیت مقالات یاری کنید.
تمامی حقوق مادی و معنوی این سایت متعلق به سایت جی اس ام باتری می باشد.
بسیار کاربردی عالی بود
سلام دوست عزیز
خوشحالیم که مورد توجه شما بودیم
من دانشجو هستم برای بخشی از پایان نامه مقاله شما رو دیدم بسیار جامع و کامل خواستم تشکر کنم از زحمتی که کشیده اید
ممنون از مقاله خوب شما خسته نباشید
سلام وقت بخیر جناب قربانی
خوشحالیم که مورد توجه شما قرار گرفته
موفق و پیروز باشید
خواستم تشکر کنم باتوجه به این که من برای یک تحقیق دانشگاهی دنبال جمع آوری مطالبی در زمینه باتری بود بسیار لذت بردم از این همه مقاله احختصاصی
سلام و قت بخیر جناب یاوری عزیز
ممنون از حسن نظر شما ما هم خوشحالیم که باعث رضایت شما شده ایم
موفق و پیروز باشید